Stitching, Sectioning und die Z-Stapelfunktion als entscheidende Argumente für die Anschaffung des Fluoreszenzmikroskops BZ am Universitätsklinikum Düsseldorf

- Prof. Dr. Norbert Gattermann
-
Geschäftsführender Leiter des Universitätstumorzentrums (UTZ)
Oberarzt in der Klinik für Hämatologie, Onkologie, klinische Immunologie
Universitätsklinik DüsseldorfProfessor Norbert Gattermann ist geschäftsführender Leiter des Universitätstumorzentrums (UTZ) in Düsseldorf. Sein Forschungsschwerpunkt liegt auf bösartigen Erkrankungen des Knochenmarks, vor allem Präleukämien, die auch als myelodysplastische Syndrome (MDS) bezeichnet werden. Da eine bestimmte Form von MDS im Knochenmark durch ausgeprägte Eisenüberladung in den Mitochondrien der Erythroblasten (heranreifende Vorläuferzellen der roten Blutzellen) gekennzeichnet ist, interessiert er sich auch für spezielle Fragen des Eisenstoffwechsels.
Das Universitätsklinikum Düsseldorf ist seit über 30 Jahren bekannt für seine Forschungen zum myelodysplastischem Syndrom (MDS) und beherbergt ein großes MDS-Register, das sich vor allem durch eine sorgfältige Langzeit-Dokumentation der Krankheitsverläufe auszeichnet und daher eine hervorragende Basis für Forschungen zur Epidemiologie, Diagnostik und Risikoabschätzung dieser Erkrankungen bietet. In der Biomaterialbank des MDS-Registers sind zahlreiche Knochenmark- und Blutproben eingelagert. Norbert Gattermann und seine Kolleg*innen haben sie über Jahre hinweg gesammelt und können sie nun für molekularbiologische Analysen nutzen.
- Tissue Microarray von Knochenmarkstanzbiopsien und 3D-Zellkulturen sind eine besondere Herausforderung in der Mikroskopie
- 1. Pathophysiologie der sideroblastischen Anämie
- 2. Pathophysiologie beim myelodysplastischem Syndrom in der 3D-Zellkultur
- 3. Drug Development: Neddylation-Inhibitor
Tissue Microarray von Knochenmarkstanzbiopsien und 3D-Zellkulturen sind eine besondere Herausforderung in der Mikroskopie
Die Arbeitsgruppe MDS, Gattermann, besteht aus 2 Master Student*innen, einer Physician-Scientist sowie einem Biologisch-Technischen Assistenten (BTA).
„Das Fluoreszenzmikroskop BZ überzeugte uns nicht nur durch sein Preis-Leistungs-Verhältnis, sondern auch weil es modular erweitert werden kann. Wir sind eine kleine Arbeitsgruppe und sind sehr dankbar, dass wir Gelder einer Stiftung für die Anschaffung bekommen konnten. Nach und nach werden wir neue Module integrieren können.“
Die hämatoonkologische Arbeitsgruppe forscht auf zellulärer Ebene an drei Schwerpunkten, sodass ein Upright-Fluoreszenzmikroskop bereits zur Standardausrüstung gehört. Hier werden erfolgreich Opal-Multiplex IHC Assays mit bis zu sieben Fluoreszenzfarbstoffen durchgeführt. Dieses Mikroskop ist allerdings nicht für alle Anforderungen ausreichend, was auch ein auschlaggebendes Argument für die Anschaffung des Fluoreszenzmikroskops BZ war.
Eine Besonderheit der Arbeitsgruppe sind die eigens entwickelten Tissue Microarrays (TMAs) von MDS-Knochenmark-Stanzbiopsien, auf denen zum direkten Vergleich auch Biopsien von Patienten mit AML (akute myeloische Leukämie) sowie normale Kontrollen enthalten sind. Für die Auswertung von immunhistochemischen Untersuchungen an den TMAs ist ein großer Vorteil des Fluoreszenzmikroskops BZ, dass eine – oder sogar mehrere – Proben auf dem TMA zusammenhängend in einem Bild erfasst werden können.

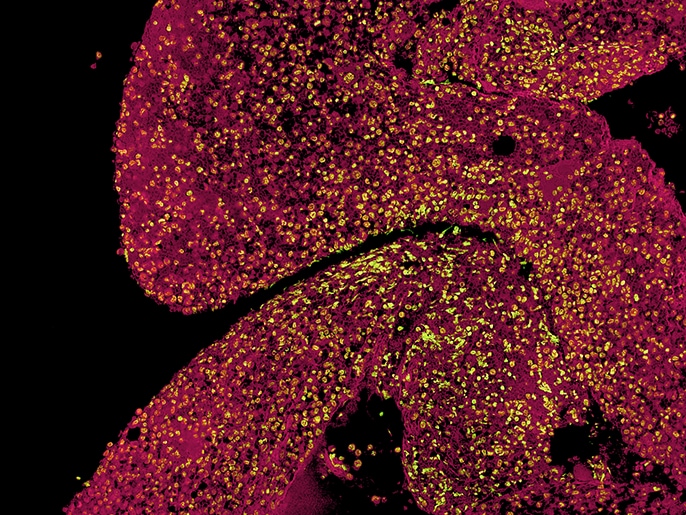
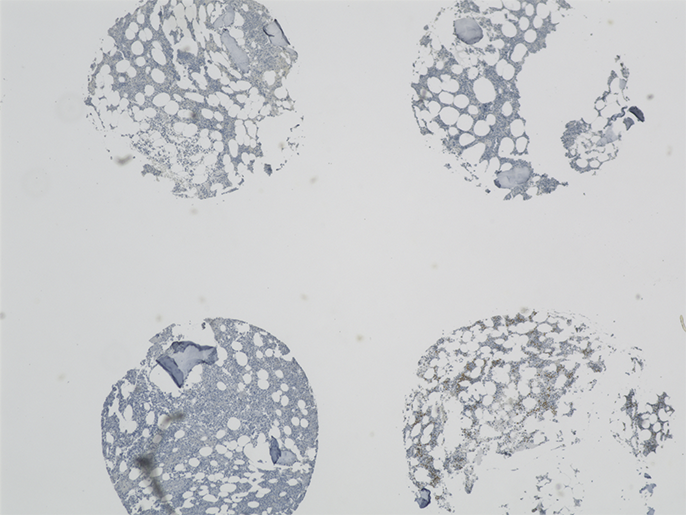
„Die Stitching-Funktion ist dabei für uns besonders wichtig, um den 2 mm großen Core in einem Bild darstellen zu können“, erklärt Norbert Gattermann.
Nützlich ist die Stitching-Funktion auch für die Auswertung von in-vitro-Kulturen von Knochenmark-Vorläuferzellen, bei denen beispielsweise als Zielstruktur die Mitochondrien von Erythroblasten untersucht werden. Ein großer Vorteil des Fluoreszenzmikroskops BZ für diese Art der Präparate ist natürlich auch der inverse Strahlengang des Mikroskops, der eine einfache Positionierung und Beurteilung der Zellkulturen ermöglicht. Und Simon Brille (BTA) findet: „Das Mikroskop und die Software sind sehr intuitiv zu bedienen. Die Analysesoftware bietet gute Möglichkeiten, Bilder schnell und unkompliziert zu bearbeiten.“
1. Pathophysiologie der sideroblastischen Anämie
Die sideroblastische Anämie ist eine Sonderform des MDS. In den Vorläuferzellen der Erythropoese findet hier eine massive Eisenüberladung der Mitochondrien statt. Seit den 50er Jahren des letzten Jahrhunderts ist diese Fehlfunktion bekannt und bis heute mechanistisch nicht geklärt. Vor einigen Jahren wurden Spliceosom-Mutationen im SF3B1-Gen gefunden, die bei 75-80 % aller Patient*innen mit sideroblastischer Anämie vorkommen. Sie führen dazu, dass die Mitochondrien zwar Eisen aufnehmen, welches aber durch das Enzym Ferrochelatase nicht effizient in Protoporphyrin eingebaut wird und sich somit in der Mitochondrienmatrix anhäuft. Das hat zur Folge, dass viel zu wenig Häm-Synthese stattfindet. Ohne Häm signalisiert die Zelle, dass noch Eisen fehlt, was zu einer weiteren Überflutung der Mitochondrien mit Eisen führt. Hier oxidiert das überschüssige Eisen und schädigt die Mitochondrien.
Interaktionen an der Mitochondrien-Membran besser verstehen
Norbert Gattermann und seine wissenschaftlichen Mitarbeiter*innen forschen zu Protein-Interaktionen an der inneren Mitochondrien-Membran und in der Matrix, um herauszufinden, warum das Eisen und das Porphyrin nicht richtig zusammenkommen. Mit dem Fluoreszenzmikroskop BZ werden Membrankomplexe auf strukturelle Anomalien untersucht, indem Protein-Protein-Interaktionen mit dem Proximity Ligation Assay (PLA) als Fluoreszenzsignale sichtbar gemacht werden. Die Sectioning-Funktion ermöglicht klare Aufnahmen ohne Fluoreszenzunschärfe. Es werden nur die Signale aus den fokussierten Ebenen extrahiert und daraus eine tiefenscharfe Aufnahme erzeugt. Die untersuchten Protein-Interaktionen betreffen die Ferrochelatase und ihre, zum Teil nur temporären, Interaktionspartner im „mitochondrial heme metabolism complex“.
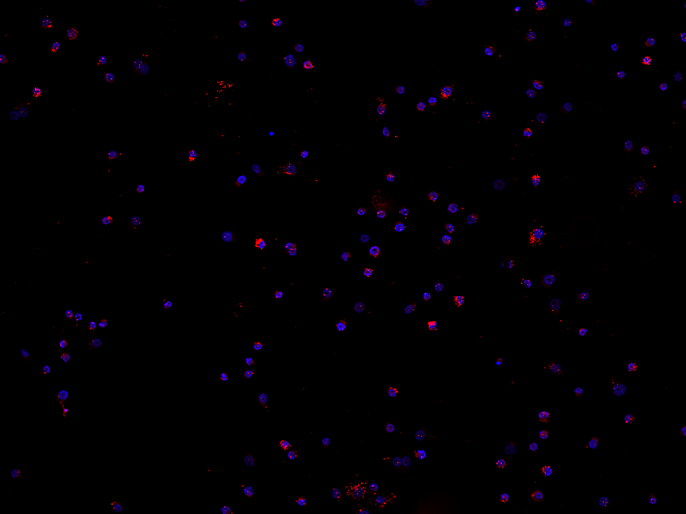
„Beim Besuch einer Arbeitsgruppe in Bonn platzten wir in eine Vorstellung des Fluoreszenzmikroskops BZ und waren sofort fasziniert von all den Möglichkeiten, die dieses kompakte Gerät bietet!“ erinnert sich Fatemeh Majidi, Physician Scientist.
2. Pathophysiologie beim myelodysplastischem Syndrom in der 3D-Zellkultur
Um das Verhalten von Knochenmarkvorläuferzellen realitätsnah darzustellen und zu verstehen, etabliert Norbert Gattermann mit seiner Arbeitsgruppe zurzeit die 3D-Zellkulturtechnologie in seinem Labor. In der Vergangenheit wurde der übliche zweidimensionale Colony Forming Assay durchgeführt. Ein Verfahren, bei dem hämatopoetische Vorläuferzellen in einem halbfesten Medium Kolonien bilden und auf diese Weise untersucht werden können. Für die 3D-Zellkultur sind die Anforderungen an die Mikroskopie noch einmal gestiegen. Besonders die Z-Stapelfunktion, das Stitching und das Sectioning-Feature des Fluoreszenzmikroskops BZ werden hier zum Einsatz kommen. Diese Funktionen sind entscheidende Argumente für die Anschaffung des Fluoreszenzmikroskops BZ gewesen. Norbert Gattermann und seinen Mitarbeiter*innen eröffnen sich ganz neue Visualisierungsmöglichkeiten für Anwendungen aus der Immunhistochemie, für Zellkernfärbung und den Nachweis von DNA-RNA-Hybridstrukturen in der 3D-Zellkultur.
3. Drug Development: Neddylation-Inhibitor
Zurzeit wird in klinischen Studien ein Neddylation-Inhibitor getestet, dessen Wirkung noch nicht vollständig erforscht ist. Wie sich das neue Medikament auf hämatopoetische Vorläuferzellen und deren Differenzierung auswirkt, wird auch von der AG Gattermann untersucht. Unter anderem wird mit dem Proximity Ligation Assays (PLA) am Epidermal Growth Factor Receptor (EGFR) die Homodimerisierung des Rezeptors an der Zelloberfläche nachgewiesen, die eine Rezeptor-Phosphorylierung im Zellinneren nach sich zieht und somit Signalwirkung im Hinblick auf Zellproliferation entfaltet. Zum Zeitpunkt des Interviews mit Professor Gattermann konnten noch keine genaueren Angaben gemacht werden, weil sich erste Ergebnisse noch im Veröffentlichungsprozess befinden.
Die Anschaffung des Fluoreszenzmikroskops BZ ist ein Highlight für die Arbeitsgruppe von Norbert Gattermann. Über translationale Projekte innerhalb der Universität Düsseldorf wird das Fluoreszenzmikroskop BZ auch anderen Forschenden zur Verfügung stehen.